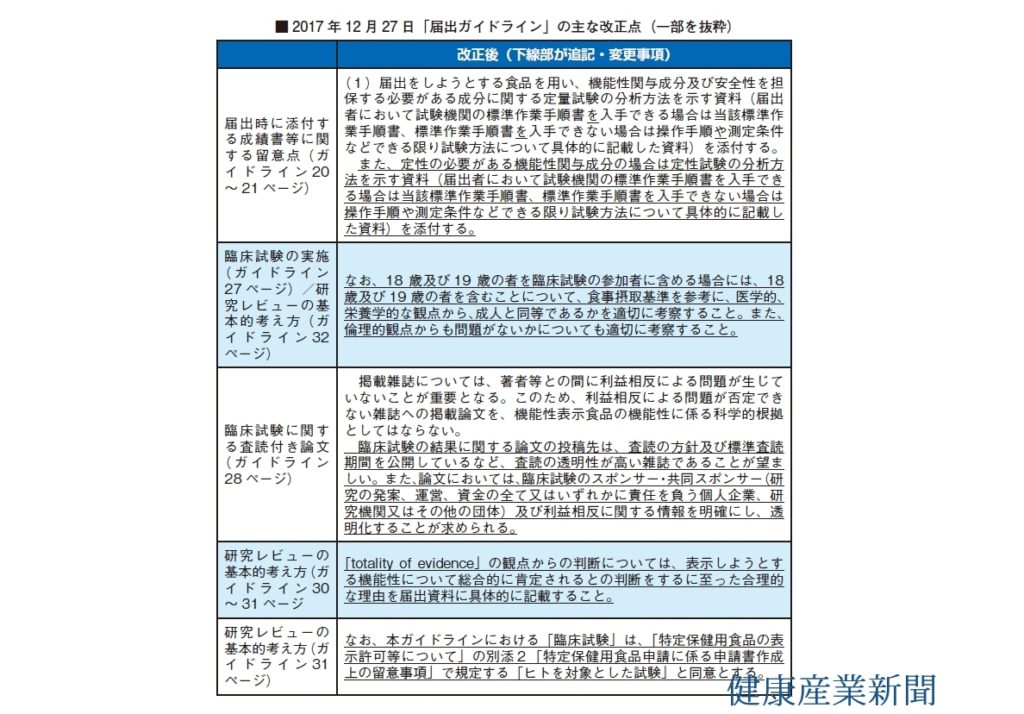
消費者庁は先月27日、「機能性表示食品の届出等に関するガイドライン」を改正した。今回の改正は、事業者から問い合わせの多い事項を明確にする観点から実施。適切に考察された18~19歳データが使用可能であることなどを明確にした。次のガイドライン改正は「糖質・糖類」の追加が濃厚。さらには「業界団体による書類事前チェック」といった制度の改善策と、「エキス類の追加」や、「食薬区分の運用見直し」も控えており、2018年は機能性表示食品の制度拡充に向けた節目の年となる。
「定性試験」、開示に注文も
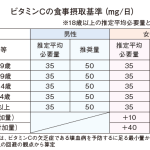
文言などの修正のほか、①定性試験について、②18~19歳を含むデータの扱い、③望ましい論文の投稿先、④トータリティオブエビデンスの判断理由、⑤臨床試験の定義――など。
①は、定性の必要がある機能性関与成分の場合、定性試験の分析方法を示す資料を添付することを規定した。当該成分が含まれているか、第三者の外部機関がチェックできるようにする狙いがある。企業からは「定量もそうだが、分析法は企業のノウハウが……
ウェブでは一部を公開しています。全文は「健康産業新聞」紙面(2018年1月17日発行・1636号)で
「エキス類」の追加は4月以降に
今回の改正は、届出資料の質の向上を図る点が主眼。規制改革実施計画で2017年中の措置が求められていたことへの対応になる。制度拡充は2018年が“本番”だ。
2016年12月にまとまった検討会報告書で追加が決まったうち、「エキス類」はデータベース改修が今年4月以降の作業になるため、使用できるようになる時期はその作業の進捗に左右される。
一方「糖質・糖類」は、節目の年度末にガイドライン改正があれば、その時に追加される可能性もある。まずは、特保で許可実績のあるL-アラビノース……
ウェブでは一部を公開。記事は「健康産業新聞 1636号/2018年1月17日号」に掲載しています。「健康産業新聞」(月2回発行/1号あたりの平均紙面数は約50ページ)定期購読のお申し込みはこちら
<関連記事>
・医薬品リストの機能性表示、「検討を予定」
・【話題追跡】消費者庁、機能性表示食品の「臨床試験」を検証
・機能性表示食品、市場規模1690億円見込み TPC調査
・セミナーレポート「健康被害の申出、その時どうする―厚労省が対応強化へ、消費者サイドとあるべき対応を探る―」JADMAサプリ塾